徐曙彤
博士生导师
硕士生导师
教师姓名:徐曙彤
教师拼音名称:Xu Shutong
电子邮箱:
所在单位:生命科学技术学院
学历:博士研究生毕业
办公地点:华中农业大学第一综合楼A429
性别:女
学位:博士
职称:教授
在职信息:在职
毕业院校:中国科学院上海生命科学研究院
所属院系:生命科学技术学院
通讯/办公地址:
邮箱:
当前位置:
中文主页
>
研究方向
酶的结构与作用机制
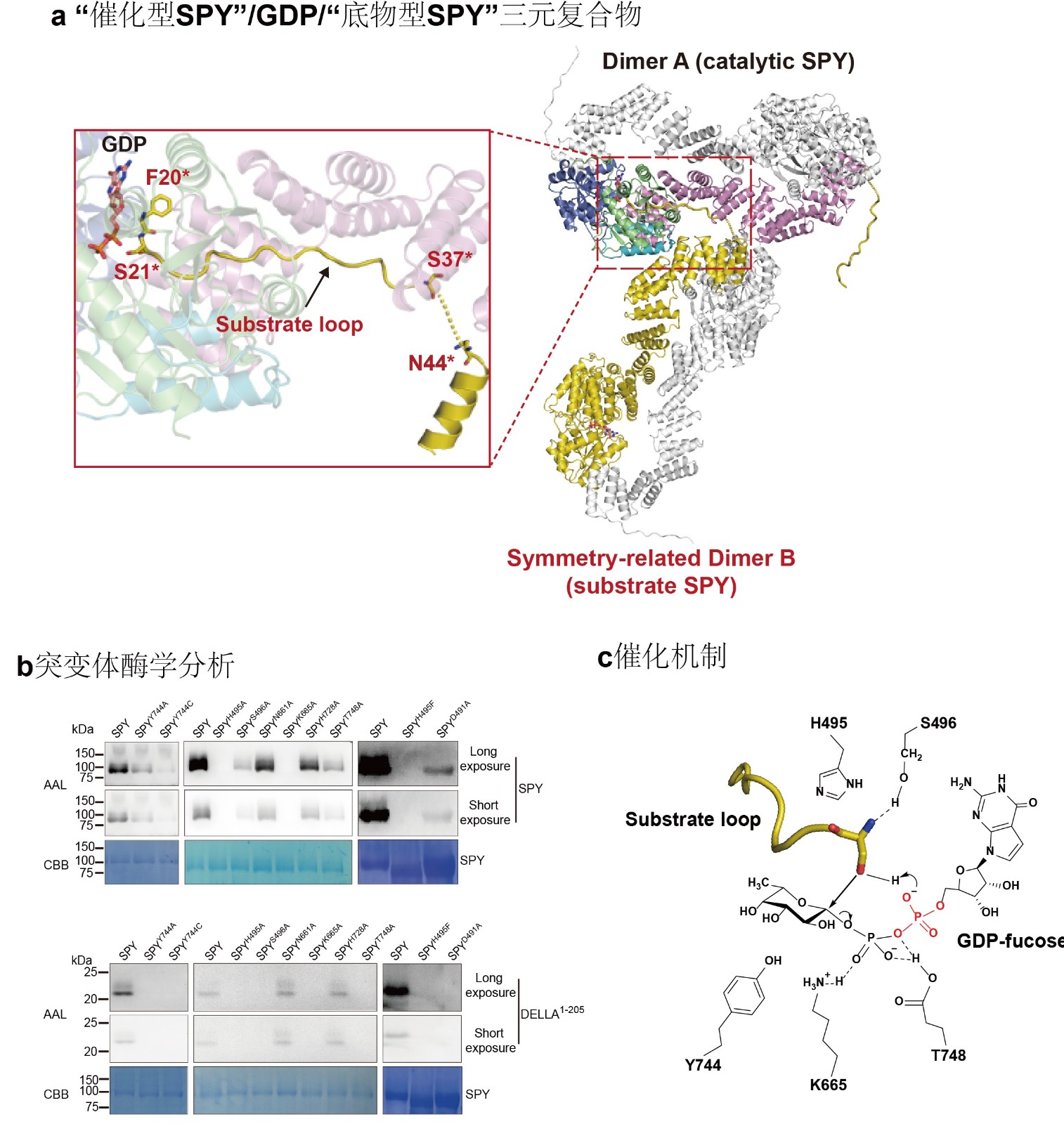
1)阐释新型O-连接岩藻糖转移酶SPINDY的作用机制(Nature Communications 2022)
蛋白质的O-连接糖基化是实现蛋白质功能多样化、动态地调节胞内信号整合和细胞生理状态的关键机制。植物SPINDLY (SPY)蛋白在植物发育过程中发挥着多效性作用,包括生物钟调控、植物激素细胞分裂素信号转导、植物构型、根系发育、非生物和生物胁迫等。近年来的研究表明SPY是一种新型蛋白质O-连接岩藻糖基转移酶,可特异性地催化赤霉素信号转导关键转录因子DELLA以及生物钟核心元件PRR5并调控这些蛋白的功能。SPY同源蛋白广泛存在于许多生命物种,包括原核生物、原生生物、藻类和所有植物,这表明SPY催化蛋白发生O-连接岩藻糖基修饰是一种广泛存在的调控胞内蛋白功能的方式。本课题组综合运用结构生物学和生物化学等多学科手段,解析SPY蛋白与底物复合物的晶体结构,在晶格中意外捕获了由对称相关分子构成的 “催化型SPY”/GDP/“底物型SPY”三元复合物构象,首次观察到完整的GT41家族酶与蛋白底物的结合模式。结合生物化学实验分析,研究者阐释了SPY的酶活调控机制;揭示了SPY特异性识别糖基供体GDP-fucose和蛋白底物的机理;阐明了SPY独特的酶学催化反应机制;同时为GT41家族成员特异性选择糖基供体提供理论依据。